 Gyakran modják (főleg persze biológusok), hogy létezik egy orvosi és egy biológiai Nobel-díj - csak a biológiait történetesen kémiainak hívják. A Nobel-díjról döntő bizottság a tavalyi évvel ellentétben idén nem cáfolt rá erre az aforizmára, és a zöld fluoreszcens fehérje (green fluorescent protein, GFP) felfedezéséért, felhasználásáért és fejlesztéséért megosztva Osamu Shimomurának, Martin Chalfienek és Roger Y. Tsiennek adta a 2008-as kémiai Nobel-díjat. Ennek apropóján bemutatjuk nektek, hogyan vált a Csendes-óceáni medúzák világító fehérjéje napjaink biológiai kutatásainak elengedhetetlen kellékévé.
Gyakran modják (főleg persze biológusok), hogy létezik egy orvosi és egy biológiai Nobel-díj - csak a biológiait történetesen kémiainak hívják. A Nobel-díjról döntő bizottság a tavalyi évvel ellentétben idén nem cáfolt rá erre az aforizmára, és a zöld fluoreszcens fehérje (green fluorescent protein, GFP) felfedezéséért, felhasználásáért és fejlesztéséért megosztva Osamu Shimomurának, Martin Chalfienek és Roger Y. Tsiennek adta a 2008-as kémiai Nobel-díjat. Ennek apropóján bemutatjuk nektek, hogyan vált a Csendes-óceáni medúzák világító fehérjéje napjaink biológiai kutatásainak elengedhetetlen kellékévé.
 A sztori tehát a Csendes-óceán, pontosabban a hangulatos nevű Friday Harbor nevű kisváros partján kezdődött 1961-ben, ahova a Princeton Egyetem fiatal japán kutatója, Osamu Shimomura azért érkezett, hogy mintát gyűjthessen az Aequorea victoria nevű medúzából. Ez a medúza azért volt számára érdekes, mert ismert volt róla, hogy zölden világít, és Shimomura, aki a biolumineszcens fehérjék iránt érdeklődött, meg akarta tudni, milyen fehérje áll ennek hátterében. A sikeres mintagyűjtést és néhány további hónapnyi munkát követően sikeresen azonosította is a medúza fő fényforrását jelentő fehérjét, az aequorint. Ez a fehérje azonban meglepetésre nem zöld, hanem kék fénnyel világított, dacára annak, hogy a medúza vizsgált része egyértelműen zöld volt. Viszont megvolt az a tulajdonsága, hogy ezt a Ca2+ ion koncentráció függvényében tette, ezért a következő években Shimomura egy erre a fehérjére alapuló Ca2+ szenzort igyekezett fejleszteni. Bár már az első publikációjukban megemlítik, hogy egy másik, zölden fluoreszkáló fehérjét is azonosítottak az extraktumokból, mégis éveknek kellett eltelnie, hogy Shimomura figyelme efelé a fehérjé felé forduljon. Ezt a zölden fluoreszkáló későbbi sztárfehérjét, a GFP-t csak a '70-es években vette górcső alá, amikor is azonosította benne a fluoreszcenciáért felelős csoportot, az úgynevezett kromofórt.
A sztori tehát a Csendes-óceán, pontosabban a hangulatos nevű Friday Harbor nevű kisváros partján kezdődött 1961-ben, ahova a Princeton Egyetem fiatal japán kutatója, Osamu Shimomura azért érkezett, hogy mintát gyűjthessen az Aequorea victoria nevű medúzából. Ez a medúza azért volt számára érdekes, mert ismert volt róla, hogy zölden világít, és Shimomura, aki a biolumineszcens fehérjék iránt érdeklődött, meg akarta tudni, milyen fehérje áll ennek hátterében. A sikeres mintagyűjtést és néhány további hónapnyi munkát követően sikeresen azonosította is a medúza fő fényforrását jelentő fehérjét, az aequorint. Ez a fehérje azonban meglepetésre nem zöld, hanem kék fénnyel világított, dacára annak, hogy a medúza vizsgált része egyértelműen zöld volt. Viszont megvolt az a tulajdonsága, hogy ezt a Ca2+ ion koncentráció függvényében tette, ezért a következő években Shimomura egy erre a fehérjére alapuló Ca2+ szenzort igyekezett fejleszteni. Bár már az első publikációjukban megemlítik, hogy egy másik, zölden fluoreszkáló fehérjét is azonosítottak az extraktumokból, mégis éveknek kellett eltelnie, hogy Shimomura figyelme efelé a fehérjé felé forduljon. Ezt a zölden fluoreszkáló későbbi sztárfehérjét, a GFP-t csak a '70-es években vette górcső alá, amikor is azonosította benne a fluoreszcenciáért felelős csoportot, az úgynevezett kromofórt.
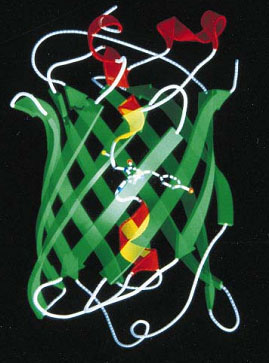
A GFP fehérje szerkezete középen a fluoreszcenciáért felelős kromofór csoporttal.
Itt egy rövid kitérő erejéig el kell hogy mondjuk, minek is köszönhető maga a fluoreszcencia. A fluoreszcencia egy olyan folyamat, aminek során bizonyos molekulák adott energiájú fényt nyelnek el, ennek következtében valamilyen nagyobb energiájú állapotba kerülnek, majd bizonyos idő alatt relaxálódnak, visszaállnak a nyugalmi helyzetükbe és eközben a felvett energia egy részét fénykibocsátás formájában leadják. Mivel azonban az energia egy része a folyamat során elveszik (disszipálódik), a kibocsátott fény kisebb energiájú, vagyis nagyobb hullámhosszú lesz, mint a gerjesztő fény. Ehhez a jelenséghez szükségünk van egy olyan molekulára, ami viszonylag könnyen átbillenthető egy magasabb energiájú állapotba. Az ilyen molekulákat hívjuk kromofóroknak. A GFP esetében ez egy para-hidroxibenzilidén-imidazolinon csoport, ami a fehérje három egymás melletti aminosav oldalláncából, egy szerinből, egy tirozinból és egy glicinből alakul ki a fehérje érése során. Az így létrejött kromofór azután képes arra, hogy az aequorin által kibocsátott kék fényt elnyelje, és helyette zöld fényt sugározzon ki. Érdekes módon egyébként a kromofór sokkal jobban gerjeszthető UV fénnyel, mint kék fénnyel, ez az oka annak, hogy a gyakorlatban ma inkább az UV fénnyel történő gerjesztést alkalmazzák a medúza eredeti kék fényű gerjesztése helyett (a medúzában ugyanis az aequorin által kibocsátott kék fény gerjeszti a végül zöld színt adó GFP-t).
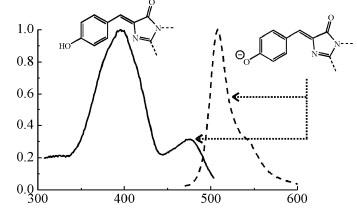
A GFP fehérje kromofórjának gerjesztési (folytonos vonal) és kibocsátási (szaggatott vonal) spektruma. Jól látható, hogy a kb. 470 nm-es kék fény csak kevéssé, míg a 400 nm alatti UV fény jelentősen képes gerjeszteni a molekulát. A kibocsátott fény 510 nm körüli, zöld fény.
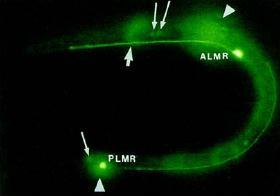
Természetesen nem véletlen, hogy Shimomura kevesebb figyelmet szentelt a GFP-nek. Azok a tulajdonságok ugyanis, amik ma olyan népszerűvé teszik, abban az időben még vagy hátrányosnak tűntek, vagy egyenesen ismeretlenek voltak. Az egyik ilyen tulajdonság az, hogy a GFP fehérje által kibocsátott fény nem függ a fehérje környezetétől. Vagyis nem alkalmazható semmiféle detektálásra, szemben például a Ca2+ ion-érzékeny aequorinnal. A másik tulajdonság, ami mára a fehérje legfőbb előnyévé vált pedig egész egyszerűen értelmezhetetlen volt abban az időben. Akkoriban ugyanis nem létezett még a genetikai módosítás lehetősége, így Shimomuráék nem tudhatták, hogy a GFP fehérjét megfelelő genetikai beavatkozás révén más fehérjékhez lehet kötni, és ami igazán fontos, a GFP nem változtatja meg ezen fehérjék működését, miközben megtartja fluoreszcens tulajdonságát. Vagyis adott fehérjékhez kötve követni tudjuk ezen fehérjék megjelenési helyét és akár esetleges mozgását is szinte bármilyen élőlénybe juttatva be a GFP-t. Ez volt az a döntő lépés, amit az idei Nobel-díj másik díjazottja, Martin Chalfie vitt véghez 1994-ben, amikor a szükséges technikák már rendelkezésre álltak. A Caenorhabditis elegans nevű, tudományos körökben népszerű féreg DNS-ébe vitte be a GFP fehérjét kódoló génszakaszt oly módon, hogy a GFP a β-tubulin fehérjével együtt fejeződött ki. Mivel a β-tubulin legnagyobb mennyiségben a tapintást érzékelő receptorokban található, a GFP is itt jelent meg, zölden kirajzolva a Caenorhabditis elegans 6 ilyen érzékelő sejtjét.
A Caenorhabditis elegans féregbe beültetett GFP fehérjék megvilágítják a β-tubulin fehérjéket, elsősorban pedig az ALMR és PLMR , tapintást érzékelő sejteket (a másik 4 ilyen sejt nem látszik a képen).
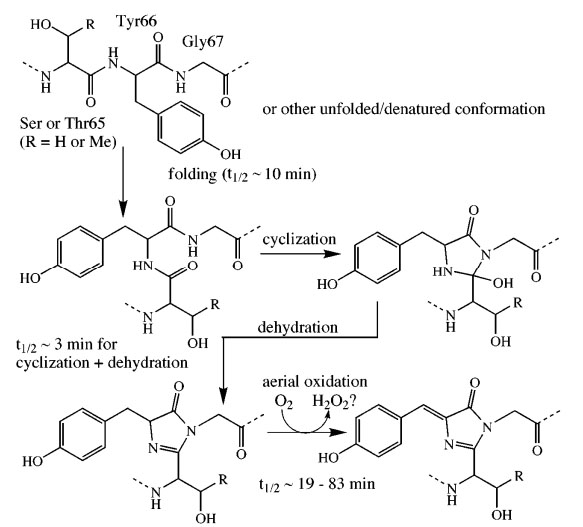
Ez volt az az áttörés, ami valójában megalapozta a GFP térhódítását. Lehetővé vált ugyanis kiválasztott fehérjék specifikus vizualizációja és monitorozása a hozzájuk kapcsolt GFP jelzőbólyák révén. Meglepő módon azonban még ekkor sem volt ismert, hogyan válik a GFP fluoreszcenssé. A fehérjéket felépítő aminosavak ugyanis fluoreszcensen inaktív vagy csak kevéssé aktív molekulák. A már Shimomura által is leírt, erősen aktív kromofór csoport kialakításához pedig az általános vélekedés szerint szükség lenne valamilyen, a folyamatot katalizáló enzimre. Az a tény azonban, hogy a GFP minden vizsgált organizmusban (melyek természetszerűleg különböző enzimekkel vannak felszerelve) működött, arra utalt, hogy nem enzim-katalizált reakcióban keletkezik az aktív forma. Erre a reakcióra adott magyarázatot még szintén 1994-ben Roger Tsien, aki leírta a molekuláris oxigén által megvalósított kromofór képződést a fehérje szerin, tirozin és glicin aminosav oldalláncaiból.
A GFP fehérje fluoreszcens kromofórjának keletkezése a szerin, tirozin és glicin aminosav oldalláncakból.
Azonban még a mechanizmus tisztázásánál is jelentősebb hozzájárulása volt a fluoreszcens fehérjék elterjedéséhez az, hogy a GFP fehérjében létrehozott pontmutációk segítségével más kromofórok kialakulását váltotta ki, amelyek természetesen más színű fényt bocsátottak ki. Lehetővé vált ugyanis így az, hogy több különböző fehérjét lehessen egymás mellett nyomon követni azáltal, hogy más-más fluoreszcens fehérjét kapcsolnak hozzájuk. Ma már több tucat különböző színű nyomjelző fehérje kapható a kereskedelmi forgalomban és a számuk napról napra növekszik.
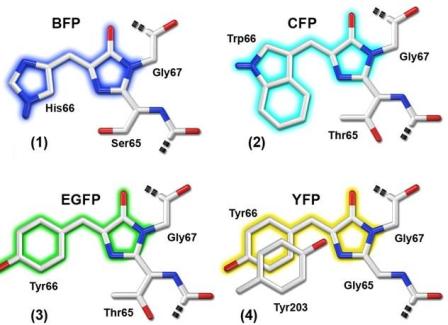
Néhány módosított GFP fehérje kromofórja: kék (BFP), cián (CFP), erősebb zöld (EGFP) és sárga (YFP) fényt kibocsátó változatok.
Összefoglalva tehát ezek a felfedezések egy olyan új eszközt adtak a kutatók kezébe, amivel addig láthatatlan folyamatokat lehet vizuálisan észlelhetővé tenni. Lehetséges például a rákos sejtek kialakulásának és burjánzásának követése, az idegrendszer megbetegedéseinek vizsgálata, vagy akár olyan, az impresszionista festményeket meghazudtoló szépségű képek készítése, amelyekről már korábban beszámoltunk.

Brainbow technikával megfestett idegsejtek. A módszer a különböző színű fluoreszcens fehérjék véletlenszerű kombinálásán alapszik.
Nem lenne azonban teljes a kép, ha nem tennénk hozzá, hogy máris feltűnt a színen a GFP és társainak egy komoly kihívója. Ugyan a fluoreszcens nyomjelző fehérjék piaca még mindig felszállóágban van, a jövőben bizonyos területeken könnyen kiszoríthatják őket az úgynevezett kvantum pöttyök (quantum dots), melyek szintetikus úton állíthatóak elő, jóval erősebb fényt adnak és színük sokkal könnyebben variálható.






Utolsó kommentek