.jpg) A gyógyszereknek hozzávetőlegesen a fele kötődik az úgynevezett G-fehérje kapcsolt receptorokhoz. Ennek a receptorcsaládnak az egyik képviselőjét sikerült most kristályosítani, - hét évvel az után, hogy az első rokon fehérje szerkezete ismertté vált. Brian Kobilka professzor és munkacsoportja a béta-2-adrenoreceptort kristályosította és ezzel a Science magazin címoldalára is került.
A gyógyszereknek hozzávetőlegesen a fele kötődik az úgynevezett G-fehérje kapcsolt receptorokhoz. Ennek a receptorcsaládnak az egyik képviselőjét sikerült most kristályosítani, - hét évvel az után, hogy az első rokon fehérje szerkezete ismertté vált. Brian Kobilka professzor és munkacsoportja a béta-2-adrenoreceptort kristályosította és ezzel a Science magazin címoldalára is került.Számos hormon és idegi jelátvivő anyag (neurotranszmitter) hat a G-fehérjéhez kapcsolt receptorokon. A jelfogó molekuláknak ebbe a családjába tartoznak a látás és a szaglás receptorai, a viselkedést és hangulatot szabályozó dopamin és szerotonin molekulák receptorai, vagy a gyulladási folyamatokban résztvevő hisztamin molekula kötésére szakosodott receptorok. A most kristályosított béta-2-adrenoreceptort pedig többek között a stressz idején felhalmozódó adrenalin aktiválja.
A G-fehérje kapcsolt receptorok szerkezetüket tekintve nagyon hasonlóak egymáshoz, mindegyikük hét olyan szakaszt tartalmaz, amely átszeli a sejtmembránt. Nevüket onnan kapták, hogy a receptorokhoz úgynevezett G-fehérjék (GTP, illetve GDP molekulát kötő fehérjék) kapcsolódnak a sejt belseje felé eső részen, amelyek akkor aktiválódnak, ha a receptor az „ellenkező térfélről”, a sejten kívüli tér felől érkező kismolekulát köt meg. A G-fehérje kapcsolt receptorok nagyméretű, membránba ágyazott molekulák, mégis igen flexibilisek, így különböző aktivált állapotokat vehetnek fel. Éppen ez az egyik oka annak, hogy nehéz is kristályosítani őket. Egészen mostanáig csak egyetlen G-fehérje kapcsolt receptor szerkezetét ismertük teljes egészében: a fényérzékelésben kulcsfontosságú szerepet játszó rodopszinét. A többi G-fehérje kapcsolt receptort erre a szerkezetre alapozva csak modellezni lehetett.
A receptorcsalád tagjai között van olyan, amelynek a membránon kívül eső részét már kristályosították, ilyen például egy glutaminsavat kötő fehérje (a metabotróp glutaminsav receptor), amelynek a sejten kívüli tér felé eső része már önmagában olyan nagyméretű, hogy külön fehérjeként is megállná a helyét. A rodopszin, és a most kristályosított béta-2-adrenoreceptor esetén viszont a teljes, membránba ágyazott régiót, a hét transzmembrán szakasz állását, apró molekuláris részleteit is megismertük. A béta-2-adrenoreceptor az adrenalin és a noradrenalin nevű hormonokat köti, amelyek szív és érrendszeri, valamint légzőszervi folyamatokat szabályoznak, így nem csoda, hogy ez a fehérje a szívgyógyszerek és az asztma-elleni gyógyszerek egyik legismertebb célpontja.
A rodopszin és a béta-2-adrenoreceptor közös vonása, hogy a hozzájuk kötődő kismolekula a membránba ágyazott részek közé illeszkedik, a fehérjék transzmembrán régióit a sejten belül és kívül kanyargó fehérjeláncok kötik össze. Az új röntgenszerkezet meghatározásakor kiderült, hogy a sejt külseje felé eső (extracelluláris) kanyarok közül a második nagyon eltér a rodopszin molekula megfelelő szakaszától, továbbá a membránbeli szakaszok pozíciója is bizonyos mértékig eltér attól, ahogy a rodopszin szerkezetből megismertük. Így bizonyossá vált, amit azért sejtettünk eddig is: a rodopszin molekula ismerete egyedül nem elég ahhoz, hogy minden G-fehérje kapcsolt receptor szerkezetére következtessünk belőle.
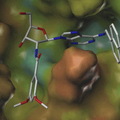
.jpg) Hogyan sikerült hosszú évek után bravúrosan kristályosítani ezt az instabil, membránba ágyazott fehérjét? Kobilka és munkatársai két megközelítést is közöltek: az egyik esetben a sejt belseje felé eső egyik kanyarhoz (IC3 loop) egy ellenanyag molekulát kötöttek, a másik esetben ezt a belső kanyarodó szakaszt helyettesítették a stabil, többször kristályosított T4 lizozim molekulával (képünkön). A membrán helyettesítésére a két esetben eltérő lipidkörnyezetet alkalmaztak. Mindkét módszerrel sikerült meghatározni a szerkezetet: először az ellenanyaggal kombinált fehérje szerkezetét közölték a Nature című folyóiratban, majd néhány napra rá a Science magazinban megjelent a nagyfelbontású (pontosabb részleteket tartalmazó) szerkezet, amely a T4 lizozim molekulát tartalmazza. A röntgendiffrakciós felvételeket mindkét esetben, szinkrotronban előállított igen intenzív röntgensugárral készítették. Fontos eredmény, hogy noha a két szerkezetben eltérő a lipidkörnyezet és a kristályosítás érdekében végzett módosítás, a membránbeli szakaszok helyzete mégis hasonló. Ez azt jelenti, hogy ezek a részletek elég megbízhatóak, kicsi az esélye, hogy két eltérő módszer, azonos hibát okozzon.
Hogyan sikerült hosszú évek után bravúrosan kristályosítani ezt az instabil, membránba ágyazott fehérjét? Kobilka és munkatársai két megközelítést is közöltek: az egyik esetben a sejt belseje felé eső egyik kanyarhoz (IC3 loop) egy ellenanyag molekulát kötöttek, a másik esetben ezt a belső kanyarodó szakaszt helyettesítették a stabil, többször kristályosított T4 lizozim molekulával (képünkön). A membrán helyettesítésére a két esetben eltérő lipidkörnyezetet alkalmaztak. Mindkét módszerrel sikerült meghatározni a szerkezetet: először az ellenanyaggal kombinált fehérje szerkezetét közölték a Nature című folyóiratban, majd néhány napra rá a Science magazinban megjelent a nagyfelbontású (pontosabb részleteket tartalmazó) szerkezet, amely a T4 lizozim molekulát tartalmazza. A röntgendiffrakciós felvételeket mindkét esetben, szinkrotronban előállított igen intenzív röntgensugárral készítették. Fontos eredmény, hogy noha a két szerkezetben eltérő a lipidkörnyezet és a kristályosítás érdekében végzett módosítás, a membránbeli szakaszok helyzete mégis hasonló. Ez azt jelenti, hogy ezek a részletek elég megbízhatóak, kicsi az esélye, hogy két eltérő módszer, azonos hibát okozzon.A szerkezetről eddig csak modelljeink lehettek, most már valóságos képünk is van, - legalábbis a fehérje egy kiragadott állapotában. Az aktivált állapotot talán csak akkor ismerjük meg igazán, ha egyszer magával a G-fehérjével együtt is sikerül kristályosítani a receptort. Az aktiválódás mechanizmusának felderítéséhez, a működés teljes megértéséhez tehát még sok információra van szükségünk, de a módszer ott van a kutatók kezében, talán nincs messze az idő, hogy a fehérjecsalád többi tagját is megismerjük.
Források:
http://med.stanford.edu/news_releases/2007/october/kobilka.html
http://omicsomics.blogspot.com/2007/10/at-long-last-2nd-gpcr-crystal-structure.html
http://en.wikipedia.org/wiki/G_protein-coupled_receptor
Az eredeti cikkek az alábbi linkeken tekinthetők meg:
Science (2007. november 23).
http://www.sciencemag.org/cgi/content/abstract/1150609
http://www.sciencemag.org/cgi/content/abstract/1150577
Nature (2007. november 15).
http://www.nature.com/nature/journal/v450/n7168/abs/nature06325.html
Nature Methods (2007 november).
http://www.nature.com/nmeth/journal/v4/n11/abs/nmeth1112.html





Utolsó kommentek