 Közvetlenül rákapcsolódni az agyra fény segítségével - ennek a lehetősége már nem vad képzelgés. Mikrobák fényérzékeny fehérjéit idegsejtekbe ültetve szabályozni lehet működésüket a rájuk eső fény színével és intenzitásával.
Közvetlenül rákapcsolódni az agyra fény segítségével - ennek a lehetősége már nem vad képzelgés. Mikrobák fényérzékeny fehérjéit idegsejtekbe ültetve szabályozni lehet működésüket a rájuk eső fény színével és intenzitásával. A "csodafehérjéket" úgy hívják channelrhodopsin-2 (ChR2) és halorhodopsin (HR). Ez két olyan mikrobában (a zöld alga Chlamydomonas reinhardtii és az archea Natromonas pharaonis) előforduló fehérje, amely kék illetve sárga fény hatására nátrium illetve klorid ionokat engednek át magukon. Ezek a fehérjék a neuronokban - egymás jin és jangjaként - ellentétes irányban változtatják meg az idegsejtek működését. A kék (470 nm) hullámhossz tartományban aktiválható ChR2 a nátrium ionok beeresztésével depolarizálja az idegsejtet, ami fokozott aktivitáshoz, több akciós potenciál generálásához vezet. Ezzel ellentétben a HR, sárga (580 nm) fény hatására klorid ionokat pumpálva a neuronokba hiperpolarizálja, vagyis "lecsendesíti", gátolja azokat.
Ellentétben az idegsejtek ingerlésének extracelluláris elektromos módszerével - amivel egyszerre több és többféle idegsejtet lehet csak ingerelni -, a fény kisebb területre fókuszálható, mozgatható és kizárólag azokat a sejttípusokat fogjuk aktiválni vele amelyekben kifejeződik a ChR2 és a HR.
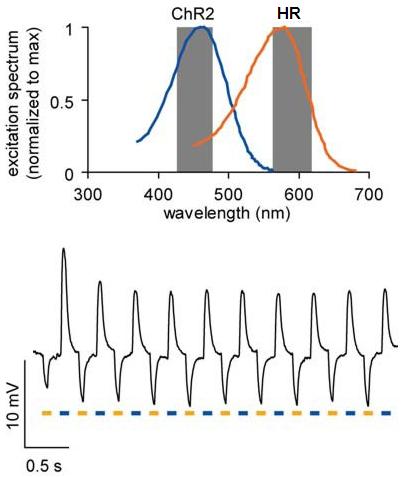
Az ábra (Han és Boyden 2007 alapján) felső részén látható, milyen hullámhosszúságú (vagyis milyen színű) fénnyel lehet aktiválni a ChR2 és a HR fehérjéket. A szürkére satírozott részek mutatják azokat a tartományokat amelyeket a jelenleg is kapható színszűrőkkel ki lehet emelni a teljes spektrumból. A kép alsó felén pedig egy olyan idegsejt kék illetve narancs színű fényre adott reakciója látható amelyben egyszerre kifejezték a ChR2-t és a HR-t. Amikor kék fénnyel világították meg depolarizálódott, amikor narancssárgával, hiperpolarizálódott.
Miért annyira izgalmas ez a hír? Mert anélkül befolyásolhatunk idegsejteket, hogy bármit is beleszúrnánk az idegszövetbe. Ez által nincs elektród ami körül gliózis alakulhatna ki (ez tulajdonképpen egy hegszövet-szerűség ami az idegen test körül alakul ki glia sejtekből, elektromosan is elszigetelve azt az idegszövettől), nincs melegedés, valamint térben és időben meghatározott mintázatú ingerlést adhatunk az idegszövetre a megfelelő optikai eszközökkel. Ilyen, sejt-szintű ingerlést lehetővé tévő eszközök jelenleg a konfokális pásztázó mikroszkóp és talán nemsokára a két-foton pásztázó mikroszkóp (lásd a megjegyzést a post végén) is alkalmas lesz a ChR2/HR-sejtek vezérlésére. Ez utóbbi közeli infravörös fénnyel dolgozik és ezért az infravörösben átlátszóbb agy mélyebb rétegei is elérhetők lennének vele.
A fenti kép azonban egy egyedi, az agyból kivett sejtből elvezetett, fényre adott válaszokat mutat be. Mikor lesz ebből valami, amivel magára az élő agyra lehet hatni?
Sokat nem kell várni, mert már bizony itt tartunk!
Az utóbbi két évben több olyan cikk is megjelent amelyben leírták, hogy állatokba juttatva a ChR2/HR fehérjéket kódoló géneket, képesek voltak a megcélzott sejteket fényre reagálóvá tenni. Ezek közül most csak hármat emelnék ki, amelyek közül kettő az akcióspotenciál-on megjelent korábbi bejegyzésekhez is kötődik.
Béna férgecske
A Nature ez év április 5-i számában Zhang és munkatársai leírták a ChR2 és a HR sikeres bejuttatását a Caenorhabditis elegans izmaiba illetve neuronjaiba (olyan idegsejtek, amelyek közvetlenül izmokhoz kapcsolódva irányítják azokat) - majd a különböző színű fénnyel befolyásolni tudták a Nobel díjas állat mozgását. A videófelvétel egy olyan állatkáról készült amelyikbe HR-t vittek az izomsejtekbe, majd rövid időközökre megvilágították (amit a sárga pötty jelez).
Vakegér
A Neuron szaklap múlt év áprilisi számában számoltak be Bi és munkatársai arról, hogy az öröklődő fotoreceptor sejt degeneráció miatt megvakuló rd/rd törzs egerei retinájába juttatva a ChR2-t, sikerült a retinában megmaradt idegsejteket kék fénnyel ingerelhetővé tenni. Mégpedig annyira, hogy a kék fényfelvillanással kiváltott elektromos válasz a látókéregbe is eljutott! Az ábrán látható, egy "VEP" (visual evoked potential) amit legegyszerűbben vizuális kiváltott potenciálnak fordítanék. Ez a VEP akkor mérhető a koponyán, az occipitális lebeny felett, ha felvillantunk egy fényingert.
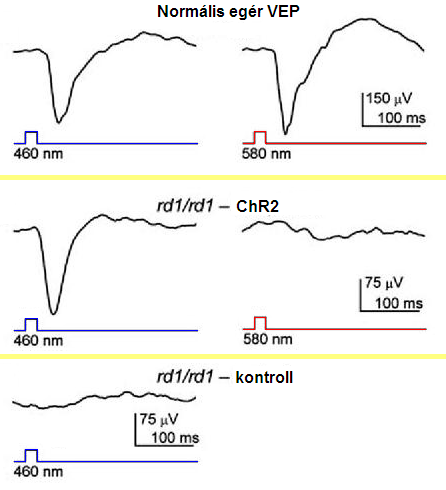
Ezzel lehetőség nyílik arra, hogy a retinába chip helyett fehérjéket ültetve és ezen fehérjéken keresztül a retina megmaradó ganglion sejtjeit kék - illetve a HR-t is bejuttatva piros - fénnyel vezéreljük. Ez azt jelenti, hogy a retina protézis a retinába ültetett chip nélkül is működhet úgy, hogy egy kamera jelét rátesszük egy kék LED diódára amivel ChR2-sejteket stimulálunk (a normális megvilágítás mellett a ChR2 nem aktiválódik eléggé, ezért szükséges a kamera+LED).
Bajuszpödrő
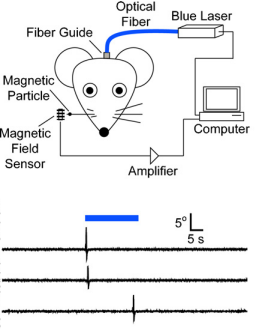 A harmadik cikk arról számol be, hogy közvetlenül az egér agykéregben expresszált ChR2-n keresztül, az egerek bajuszmozgató központjában található sejteket tudtak kék lézerfénnyel stimulálva bajuszmozgást kiváltani.
A harmadik cikk arról számol be, hogy közvetlenül az egér agykéregben expresszált ChR2-n keresztül, az egerek bajuszmozgató központjában található sejteket tudtak kék lézerfénnyel stimulálva bajuszmozgást kiváltani.Ennek a technikának nagyon sokféle felhasználása szinte magától értetődik, így már nagyban használják az agykutatásban, de új fajta gyógymód is lehet különböző, agyat érintő betegségekben vagy egy merőben új kommunikációs csatorna ember és számítógép között.
Érdemes elkezdeni szokni az optoneuronális csatlakozás kifejezést, mert azt hiszem még sokat fogunk erről hallani a közeljövőben.
Források:
PLoS. ONE 2:e299.
Nature 446:633.
Neuron 50:23.
J. Neural. Eng. 4:S143.
További javasolt olvasmányok haladóknak:
Neuron 54:205.
Neurosci Res. 54:85.
Nat Rev Neurosci. 8:577.
Megjegyzés:
Most szerdán voltam egy doktori védésen, ahol a dr Rózsa Balázs vezette csoport világszínvonalú fejlesztéseiről hallottam tőle egy nagyon jó előadást. A neten is olvasható doktori disszertáció átböngészését ajánlom mindenkinek aki ért a témához!








Utolsó kommentek