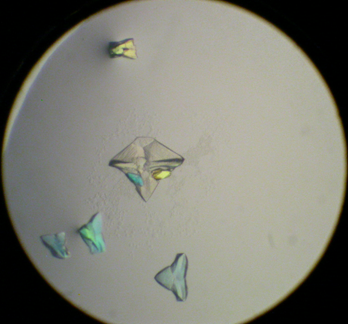
Az acilpeptid-hidroláz enzim kristályai a mikroszkóp alatt. A kristályok mérete kb. 0.7 mm volt.
Tudományosan azonban több kihívást tartogat a fehérjék kristályosítása. Amikor fehérjéket próbálunk kristályosítani, az esztétikai élvezeten és a szerencsejátékok iránti vonzalmunkon túl a kérdéses anyag szerkezetének megismerésére vonatkozó vágy vezet.
A fehérje szerkezettel sok mindent kezdhetünk, kezdjük az ipari szemponttal! A racionális gyógyszertervezés során egy konkrét célponthoz (targethez) illő molekulákat keresünk, ahogy SA a beillő kismolekulákról el is mondta korábban. Ekkor a fehérjeszerkezethez illő szerkezetű kismolekulákat keresünk, amely remélhetőleg hatóanyag lehet a fehérjével összefüggő kórság kezelésében. Ha a fehérjére ható gyógyszer még a messzi jövő ígérete, akkor is érdemes megismernünk a protein szerkezetét, mert rengeteg információt a hordoz a működéséről, szerepéről a biokémia folyamatokban.
A kristályok unalmasan sokszor ismétlik ugyanazt a szerkezetet, a kristályban lévő molekula környezetében egész pontosan ugyanolyan szerkezetű szomszédokkal találkozik, mint önmaga. A molekula szomszédokkal való kapcsolatai sem okoznak sok meglepetést, a molekulák távolságai és szögei vissza-visszatérnek. A kristálynak azt a térrészét, amelyet sokszor eltologatva és összeillesztve felépíthetjük az egész kristályt, a hangulatos "elemi cella" névvel illetjük. A molekulák tetszőleges atomját (a 15. sorszámút mondjuk) szabályos távolságokra és szögekben újra és újra megtalálhatjuk, ilyen pontok alkotják a kristályrácsot.
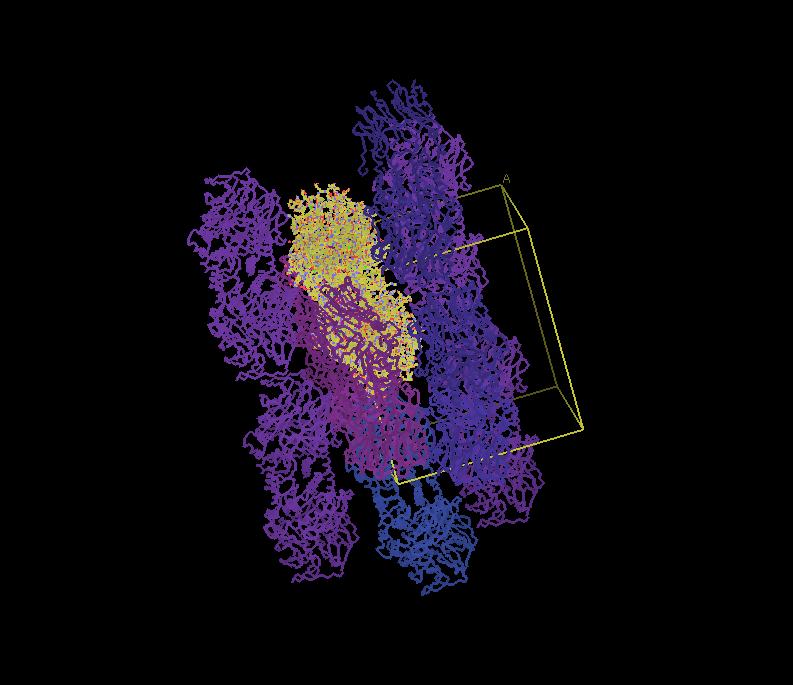

Enzimmolekulák a fenti kristályból, egy tetszőleges molekulát kiválasztunk, ez sárga, szomszédai a lila különböző árnyalatival láthatók. A sárga téglalap az elemi cellát jelöli.
Kristályunkat röntgensugarak fókuszába állítva, meghatározhatjuk az azt felépítő anyag szerkezetét, mert részecskéi kölcsönhatnak a röntgensugárzással. A röntgen tartományba eső elektromágneses sugárzás rugalmas kölcsönhatásba lép a molekulák elektronfelhőjével, és szóródik az atomokon. A sugárforrással átellenes oldalon, a kristállyal való kölcsönhatás után regisztrálhatjuk a szórt elektromágneses sugárzás intenzitását. Ez a mennyiség azért mérhető, mert sok százezerszer fordulnak elő a kristályban olyan atomok, amelyeket ugyanúgy vesznek körül az elektronok, mert az elemi cella ismétlődik újra meg újra. Nem minden elektron-röntgensugár ütközés okoz azonban mérhető intenzitást, így kevésbé veszünk el az adatokban. Csak azokról az atomokról szórt sugárzás intenzitását detektálhatjuk, amelyek esetén a kristályrács szomszédos rétegeiben lévő atomokról szórt sugárzás útkülönbsége a röntgensugárzás hullámhosszának egész számú többszöröse. Mivel az útkülönbség függ az atomok és a röntgensugár térbeli helyzetéről, ez szerkezeti információt hordoz. A kristály forgatásával ez az útkülönbség változtatható, így a különböző szögeknél más atomok szórnak, ami jelentősen megnöveli a begyűjthető információ mennyiségét.
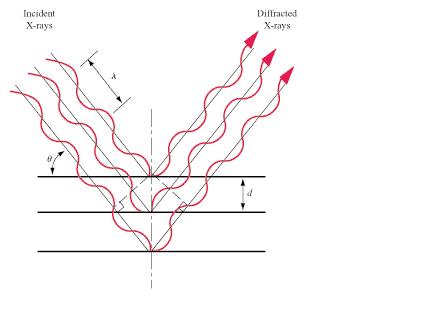
Szóródás a kristályon.
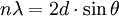
Használható kristályok növesztéséhez – azt hiszem- több szerencsére, mint szaktudásra van szükség. A fehérjék kristályosítása mindig lutri. Az ifjú kutató szeméből az évek során lassan tűnik el a tűz, ahogy telik-múlik az ösztöndíjas idő, és a kristályok nemhogy növekednének, hanem egyenesen csökkennek. Ezen a helyzeten nem sokat javít társának öröme sem, aki tíz kísérletből ragyogó kristályokat növeszt. A különbséget sokszor a véletlenben kell keresni. A szép nagy kristályok sok atomot tartalmaznak, ami a fenti logika alapján valószínűsíti a sikeres szerkezetmeghatározást.
A méret sajna nem minden. Ha a mikroszkópba nézve egy hatalmas sünre vagy egy terebélyes fűcsomóra emlékeztető látvány tárul elénk, akkor nem úszunk eufóriában: valószínűleg több pici tűszerű kristály ragadt össze. Ekkor, ami elsőre egységesnek látszik, valójában nem egykristály, hanem több egyberagadt rész. Így az első ábra utolsó kristálya sem egykristály, hanem három. Mihelyt hozzáértem, szétesett három darabra, ahogy a témavezetőm azonnal megmondta.








Utolsó kommentek