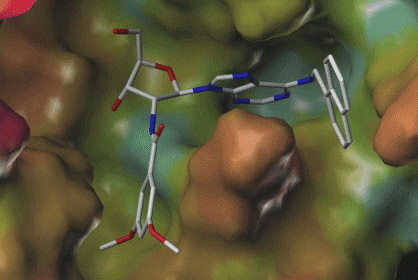 A kémia számtalan esetben sietett már a biológia segítégére amikor a különböző élettani folyamatok vizsgálatához szükséges eszközökre volt szüksége. Az egyes fehérjék funkciójának megismeréséhez elengedhetetlenül szükséges specifikus gátlószerektől a sejtek ionháztartásának változásait látható tevő fluoreszcens molekulákig rendkívül széles azon vegyületek köre, amik ma már nélkülözhetetlenek a biológiai kutatásokban. Sokkal ritkábban fordul azonban elő, hogy egy kémiai problémára a biológia kínálja a megoldást.
A kémia számtalan esetben sietett már a biológia segítégére amikor a különböző élettani folyamatok vizsgálatához szükséges eszközökre volt szüksége. Az egyes fehérjék funkciójának megismeréséhez elengedhetetlenül szükséges specifikus gátlószerektől a sejtek ionháztartásának változásait látható tevő fluoreszcens molekulákig rendkívül széles azon vegyületek köre, amik ma már nélkülözhetetlenek a biológiai kutatásokban. Sokkal ritkábban fordul azonban elő, hogy egy kémiai problémára a biológia kínálja a megoldást.
A vegyészek – és különösen a szerves kémikusok – mindig is különös tisztelettel viseltettek a természet szintetikus építőmunkásaival, az enzimekkel szemben. Nem véletlenül. A természet ugyanis hosszú évmilliók alatt tökéletesre csiszolta ezeket a fehérjéket, képessé téve őket arra, hogy rendkívül bonyolult kémiai reakciókat hajtsanak végre egyszerű körülmények között. Olyan reakciókat, amik a lombikban sokszor csak hatalmas erőfeszítések árán, nagy nyomáson vagy magas hőmérsékleten, esetleg hosszú kerülőutakat beiktatva játszódhatnak le. Érthető tehát, hogy a kémia és különösen a vegyipar szívesen használja fel ezen enzimeket különböző szerves vegyületek egyszerű, energiahatékony módon történő előállítására. Így készül többek között a penicillin is a Penicillium chrysogenum gomba enzimjei segítségével.
Sajnos azonban nem mindig van meg az a lehetőségünk, hogy egy enzimet igába fogva állíthassuk elő a számunkra szükséges vegyületeket. A modern ipar és mindennapi életünk ugyanis számtalan olyan molekula előállítását igényli, amelyek a természetben nem fordulnak elő, ennélfogva olyan enzimek sem léteznek, amelyek a hozzájuk vezető reakcióutakat katalizálnák. Hála azonban az elmúlt évtizedekben lezajlott biológiai (és mint látni fogjuk informatikai) forradalomnak, ma már az sem lehetetlen, hogy az ilyen reakciókra specifikus, mesterséges enzimeket tervezzünk és állítsunk elő.
Kulcsok a zárban
Az enzimek hatékonyságának megértéséhez vessünk egy rövid pillantást a szerves kémiai reakciók kinetikájára. Ahhoz, hogy két vegyület reakciójaként egy új vegyület keletkezhessen, a kiindulási vegyületeknek át kell jutniuk egy energiagáton, ami normál körülmények között megakadályozza, hogy a különböző vegyületek spontán módon egymásba átalakuljanak. Minél magasabb ez az energigát, annál nehezebben játszódik le a reakció, annál több energiát kell közölni a rendszerrel (például melegítéssel) ahhoz, hogy a reakció végbemehessen. Az enzimek – más katalizátorokhoz hasonlóan – elsősorban oly módon segítik a reakciók lejátszódását, hogy csökkentik az energiagát magasságát, illetve stabilizálják a reakció közben létrejövő átmeneti komplexet azáltal, hogy a reaktánsokat a reakció szempontjából legkedvezőbb konformációba kényszerítik.
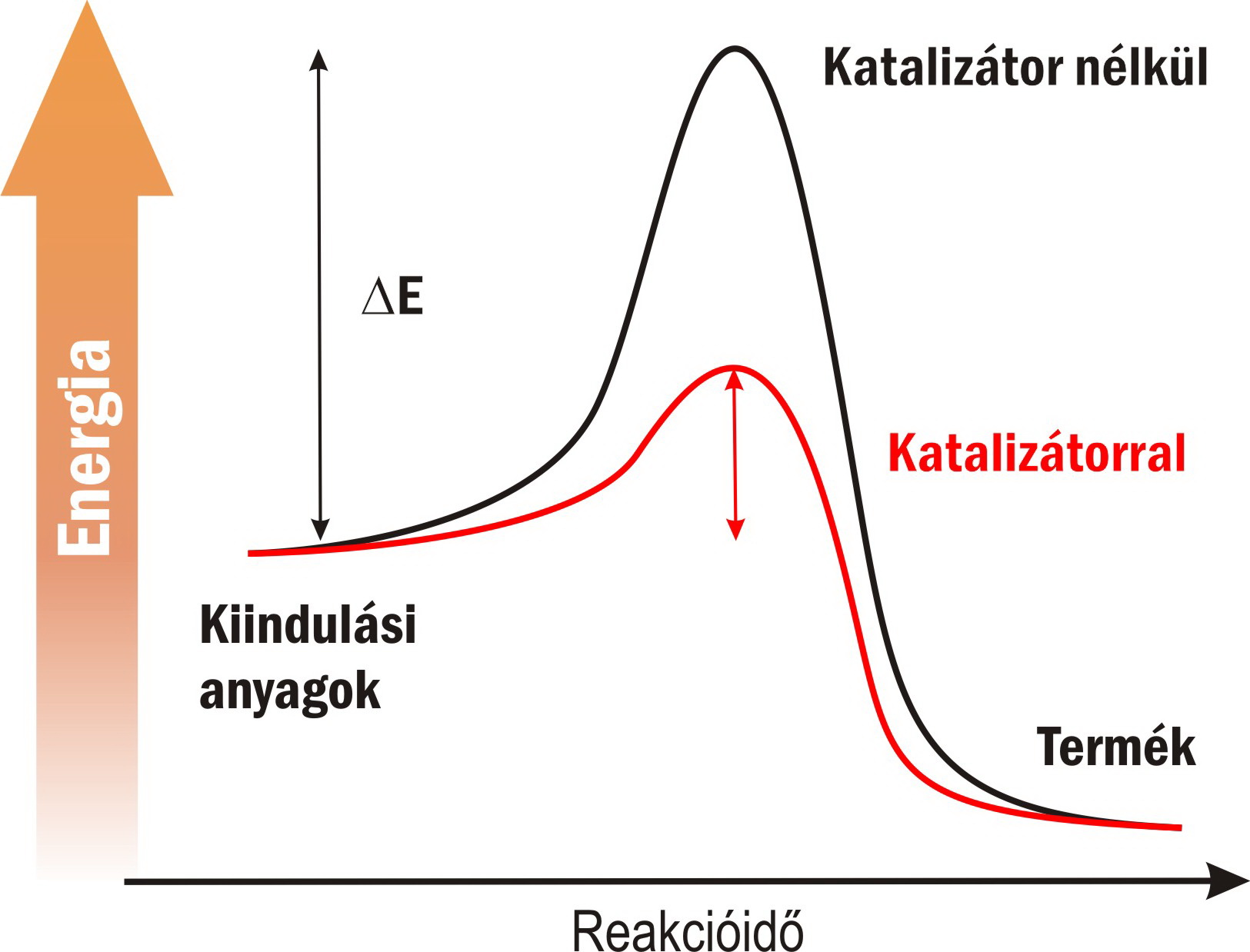
Az enzimek lecsökkentik a szerves kémiai reakciók útjában álló energigát mértékét.
Az enzimek működése szempontjából tehát legfontosabb tulajdonságuk a térbeli szerkezetük. A reakcióban részt vevő molekulákhoz képest óriási méretű enzimeknek pontosan olyan konformációba kell kerülniük, amibe, mint kulcs a zárba, a kismolekulák bele illeszkedhetnek, hogy azután az így kialakuló ideális orientációban a reakció könnyedén lejátszódhasson. Szintén a pontos térbeli orientációnak köszönhető az is, hogy a lombikban lejátszódó reakciókkal szemben az enzim katalizálta reakciókban a lehetséges térbeli konformerek közül csak egyetlen keletkezik, vagyis a reakció nagy mértékben sztereospecifikus.
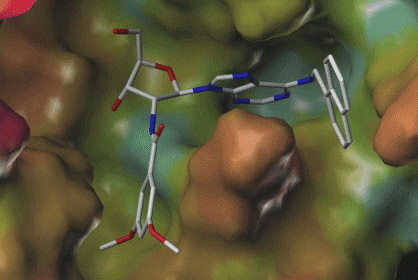
Egy enzim kötőzsebébe belesimuló kismolekula
Tervezzünk enzimet
A fentiekből következik, hogy ha mesterségesen akarunk megtervezni egy enzimet, akkor elsősorban a térszerkezetét és azon belül is kiemelten a reaktánsokat befogadó kötőzsebet, a kulcslyukat kell pontosan kialakítanunk. Egy több száz aminosavból felépülő fehérje térszerkezetét kiszámolni mind elméleti szempontból, mind a szükséges számítási kapacitás biztosítását tekintve embert próbáló feladat. Ez azonban még csak az első lépés, ugyanis a térbeli vázon túl biztosítani kell azt is, hogy a kívánt pontokon a reaktánsokat megkötni képes aminosavak helyezkedjenek el. Egy-egy aminosav lecserélése azonban szükségszerűen együttjár a térbeli szerkezet megváltozásával is, vagyis a megfelelő aminosav sorrend megtalálása folyamatos iterációt igényel. Egy washingtoni kutatócsoportnak azonban nemrégiben sikerült kifejleszteni egy eljárást, amivel ez a feladat megoldhatóvá vált.
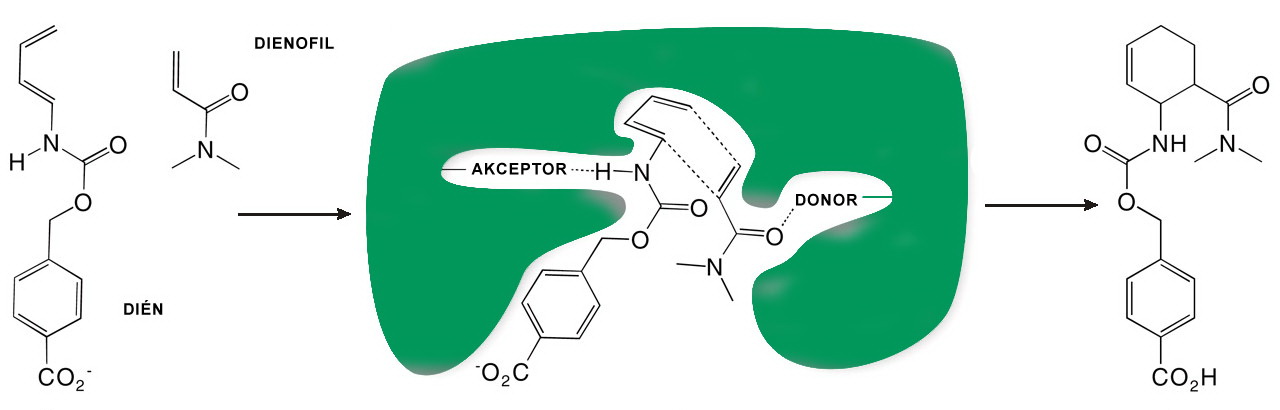
A Diels-Alder reakciót katalizáló mesterséges enzim működése.
Modellként a Diels-Alder reakciót választották, ami egy rendkívül fontos reakciótípus a szerves kémiában. A Diels-Alder reakcióban konjugált diének és úgynevezett dienofil vegyületek reakciójában egy lépésben egy ciklohexéngyűrű alakul ki, ami számtalan további reakcióban használható fel. Mivel a Diels-Alder reakció egy sokat kutatott területe a szerves kémiának, bőséges ismeretekkel rendelkezünk arra nézve, milyen körülményeket ajánlott biztosítani a reakciókészség fokozása érdekében. A kötésben résztvevő molekulapályák energiaviszonyainak optimális kialakítása szempontjából például előre tudható volt, hogy a dién partnert egy H-akceptor, míg a dienofil partnert egy H-donor segítségével érdemes kihorgonyozni a mesterséges enzimre. A kutatók ennek megfelelően abból indultak ki, hogy az enzim megfelelő helyein egy H-akceptor aminosavnak (glutamin vagy aszparagin), valamint egy H-donor aminosavnak (szerin, treonin vagy tirozin) kell lennie. Ezeket az aminosavak 207 különböző, ismert fehérjevázra helyezték rá számítógépes modellezés segítségével. Az így létrejött, hatalmas számú (1019 db) virtuális fehérjén meghatározták, hogy a kialakuló kötőzseb milyen mértékben felel meg a Diels-Alder reakció által támasztott követleményeknek, és a legjobbnak tűnő 84 fehérjét megszintetizálták. A kísérleti adatok azt mutatták, hogy a 84 fehérje közül kettőnek az előzetes várakozásnak megfelelően katalitikus hatása van a Diels-Alder reakcióra, vagyis sikerült a kívánt enzimet mesterségesen megtervezniük és létrehozniuk. A két sikeres terméket továbbfejlesztve olyan enzimet is sikerült megalkotniuk, ami az elméletileg lehetséges 4 sztereoizomer reakciótermék közül kizárólag az egyiket állította elő. A sztereospecifikus reakció jelentőségét nem nehéz belátni, ha arra gondolunk, hogy a gyógyszeripari reakciók jelentős részében a rekacióelegy haszontalan sztereoizomorektől való megtisztítása adja az előállítási költségek tetemes részét.
Bár ezek a kísérletek csak kezdeti lépéseknek tekinthetők, a reakciók hatékonysága pedig egyelőre nem éri el azt a szintet, amit a klasszikus kémiai szintézisutak kínálnak, előre jósolható, hogy a bonyolult reakciókörülményeket elegánsan megkerülő mesterséges enzimek fényes jövő előtt állnak. Ha beteljesítik a várakozásokat, akkor a jövőben nem kell újabb évmilliókat várnunk arra, hogy a számunkra fontos kémiai reakciókat a biológiára bízhassuk.






Utolsó kommentek