 A biológusok mindig is olyan új molekulák létrehozását várták a vegyészektől, amelyek kölcsönhatásba lépnek a biológiai rendszerrel. Az élet apró építőelemei, a sejtek azonban maguk is rendkívül összetett, kifinomultan működő szerkezetek és korántsem mindegy, hogy ez a kölcsönhatás hol következik be, melyik alkatrészüket érinti. Ugyanaz a vegyület ellentétes hatást is képes kiváltani két különböző típusú sejten vagy akár egyazon sejt két különböző régiójában. Nem árt tehát ha valamilyen módon befolyásolni tudjuk, hol fejtsék ki hatásukat.
A biológusok mindig is olyan új molekulák létrehozását várták a vegyészektől, amelyek kölcsönhatásba lépnek a biológiai rendszerrel. Az élet apró építőelemei, a sejtek azonban maguk is rendkívül összetett, kifinomultan működő szerkezetek és korántsem mindegy, hogy ez a kölcsönhatás hol következik be, melyik alkatrészüket érinti. Ugyanaz a vegyület ellentétes hatást is képes kiváltani két különböző típusú sejten vagy akár egyazon sejt két különböző régiójában. Nem árt tehát ha valamilyen módon befolyásolni tudjuk, hol fejtsék ki hatásukat.
Amikor a beteg beveszi a gyógyszerét vagy a vizsgálni kívánt vegyületet a mikroszkóp alatt a szövetmintára adagoljuk, abban a pillanatban egy frusztráló dolog történik: elveszítjük a kontrollt a molekuláink felett. Nem tudhatjuk, hogyan oszlottak el, eljutottak-e ahhoz a fehérjéhez vagy sejttípushoz, ahova szántuk őket. Az esetek többségében ez nem jelent problémát, ugyanis rendkívül specifikus vegyületeket használunk – a vérnyomáscsökkentő csak azt az egy fehérjét fogja gátolni, ami az erek összehúzódását szabályozza, az ezüst-nitrát pedig kizárólag a sejtmembránt festi meg a mikroszkóp alatti szöveten. Sajnos azonban nem mindig vagyunk olyan szerencsések, hogy ilyen specifikus vegyületek álljanak rendelkezésünkre. Az egyik lehetőség, amit ilyenkor tehetünk, hogy olyan inaktív vegyületeket használunk, amelyeket a kívánt helyen aktiválni tudunk, és ezáltal biztosítjuk, hogy a hatásukat csakis ott fejtsék ki. Egészen a legutóbbi időkig például nem léteztek olyan szerek, amik kizárólag a rákos sejteket pusztították volna el. Ezért alakult ki az a fajta terápia, amelyben a sejtekre nem, vagy csak kevéssé toxikus anyagot adnak be a betegnek, majd ezt az érintett szerv környékén célzott módon aktiválják (ld. a Fotodinamikus Terápia című cikkünket a Kémiai Panoráma 5. számában). Hasonló módon választhatjuk meg azt is, hogy a mikroszkópunk alatt lévő szövetben melyik sejtet, sőt annak melyik kompartmentjét vesszük vizsgálat alá. Ahhoz, hogy ezt megtehessük, két dologra van szükségünk. Egyrészt egy olyan vegyületre, ami alapállapotban nem lép köcsönhatásba a biológiai rendszerrel, de átalakítható a biológiailag aktív formává. Másrészt egy energiaközlési módra, amivel kiválthatjuk az előbb említett átalakulást.
Kezdjük talán az utóbbival – hogyan juttathatjuk az energiát a megcélzott helyre? A daganatterápiás példában ezt hőközléssel vagy fény segítségével érték el. A terápiás alkalmazásokkal ellentétben azonban a kutatásban megvan az az előnyünk, hogy közvetlenül hozzáférhetünk a vizsgálni kívánt mintához. A mikroszkóp alatt például megvilágíthatjuk. A fénnyel történő aktiválásnak igen fontos előnye van más módszerekhez – például a hőközléshez – képest. A fényt néhány specializált, fényérzékelésre szakosodott sejtet leszámítva az élő anyag nem érzékeli, így nem reagál rá és a nagyobb energiájú UV sugárzás kivételével nem is okoz károsodást a mintában. Ezen felül meglehetősen mélyen, néhány száz mikrométer, vagy akár néhány milliméter mélységben is be tud hatolni a szövetbe. A talán legfontosabb tulajdonsága pedig, hogy lézerfény formájában rendkívül jól fókuszálható, ezáltal egészen kis térrészben képes aktiválni a megcélzott vegyületet, miközben érintetlenül hagyja a környező területeket. Mindezen jó tulajdonságai tükrében nem meglepő, hogy a fénnyel történő aktiválást alkalmazzák a legelterjedtebben. Ezért nem maradt más hátra, mint hogy megalkossuk azokat a molekulákat, amik fény hatására egy biológiailag inaktív formából aktív állapotba tudnak kerülni.
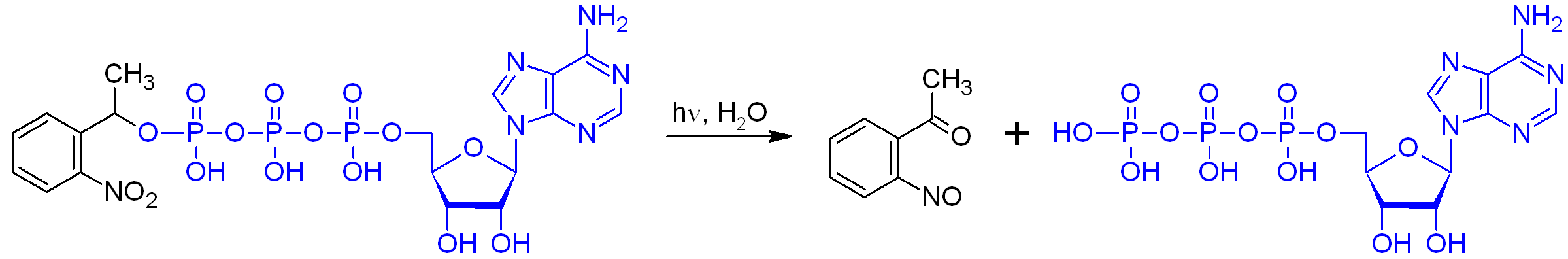
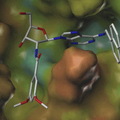
Nitrofenil-etil észter segítségével bezárt ATP aktiválása fénnyel
Hol fogy az energia?
Az első ilyen vegyületeket már a hetvenes években létrehozták és egyben megalkották a nevüket is: „caged”, azaz ketrecbe zárt molekuláknak hívták őket. Két biológiailag különösen fontos molekulának, az energiatároló ATP-nek és a hírvivő ciklikus AMP-nek készítették el a bebörtönzött változatait. A bezárás elve, amit máig is alkalmaznak az ilyen típusú reakciókban, hogy a biológiailag aktív vegyülethez (esetünkben az ATP-hez, illetve a ciklikus AMP-hez) olyan funkciós csoportot kapcsoltak, melynek révén a vegyület biológiai aktivitása megszűnt. Megvilágítás hatására azonban ez a csoport leszakad a molekuláról, így visszakapjuk az aktív formát. Az ATP esetében így lehetővé válik, hogy a sejt egy adott pontján hirtelen nagy mennyiségű ATP-t szabadítsunk fel egy fényfelvillanás segítségével és specifikusan vizsgálhassuk az ott zajló energiaigényes folyamatokat. Megtehetjük például, hogy egyetlen izomrostot aktiválunk egy teljes izomkötegből, hogy meghatározzuk annak hozzájárulását a végzett munkához, de akár a rostot felépítő fehérjék pontos szerepét is egyedileg vizsgálhatjuk a módszerrel.
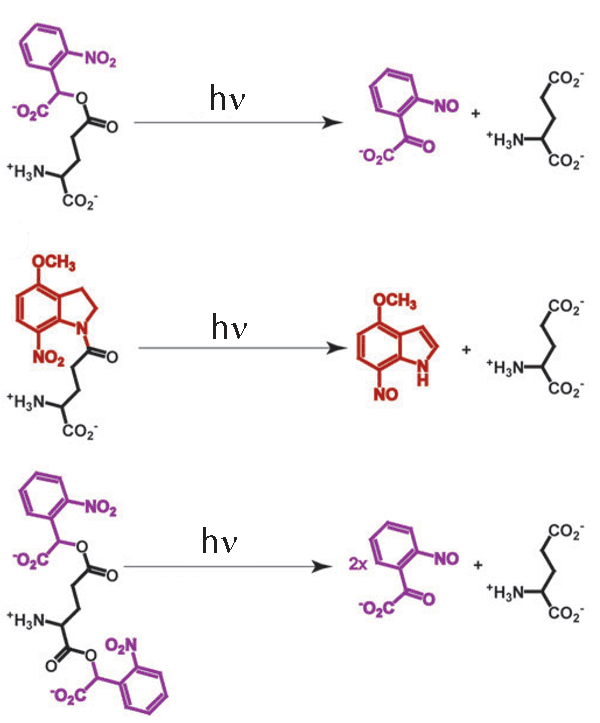
Különböző típusú bebörtönzött glutaminsavak felszabadítása fénnyel
Idegsejtek nagyító alatt
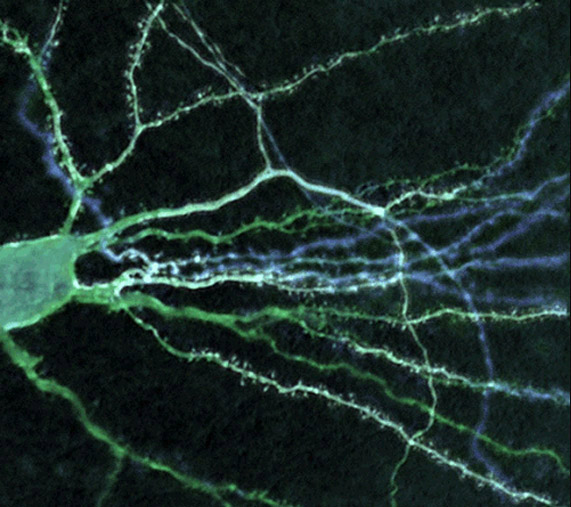
Az energiaigényes folyamatok részleteinek tanulmányozásán túl, a börtönbe zárt molekulák egy másik népszerű alkalmazása az idegrendszer vizsgálata. Az idegsejtek rendkívüli módon összetett struktúrák, amelyekben az információ feldolgozása sok-sok különböző alegységben, térbelileg elkülönülten megy végbe. Minden neuron több száz vagy akár több ezer másik neuronhoz kapcsolódik és a közöttük létrejövő kapcsolódási pontok, a szinapszisok helye határozza meg, hogy mekkora hatást tudnak kiváltani a fogadó idegsejtben. Épp ezért kiemelkedő fontosságú, hogy az egyes szinapszisoknak az egész sejtre gyakorolt hatását külön-külön vizsgálhassuk. Ez persze hatalmas feladat, hiszen egy sejt akár több tízezer szinapszissal is rendelkezik. Szerencsére nagy felbontású képeken ezek egy része jól felismerhető, ugyanis a serkentő típusú, glutaminsav által vezérelt szinapszisok többnyire a sejtek nyúlványairól, az ügynevezett dendritekről lelógó dendritikus tüskéken helyezkednek el. Ha ezeket egyenként szeretnénk vizsgálni, akkor természetesen nem tehetjük meg azt, hogy a mintát glutaminsavval kezeljük, hiszen akkor valamennyi szinapszis egyidejűleg aktiválódna. Szükségünk van olyan bebörtönzött glutaminsavra, amiből az aktiv formát kizárólag egy-egy szinapszis közelében tudjuk felszabadítani. A vegyészek szerencsére több ilyen bebörtönzött glutaminsavat is szintetizáltak, így napjainkban lehetőség van arra, hogy segítségükkel az egyedi szinapszisok mélységében is feltérképezhessük az idegsejtek működését úgy, hogy a mellékelt ábrán is látható módon a dendritikus tüskék közelében szabadítjuk ki a glutaminsavat börtönéből és az egyes tüskéken végiglépdelve megvizsgáljuk azok aktivitásának hatását a teljes sejt működésére.
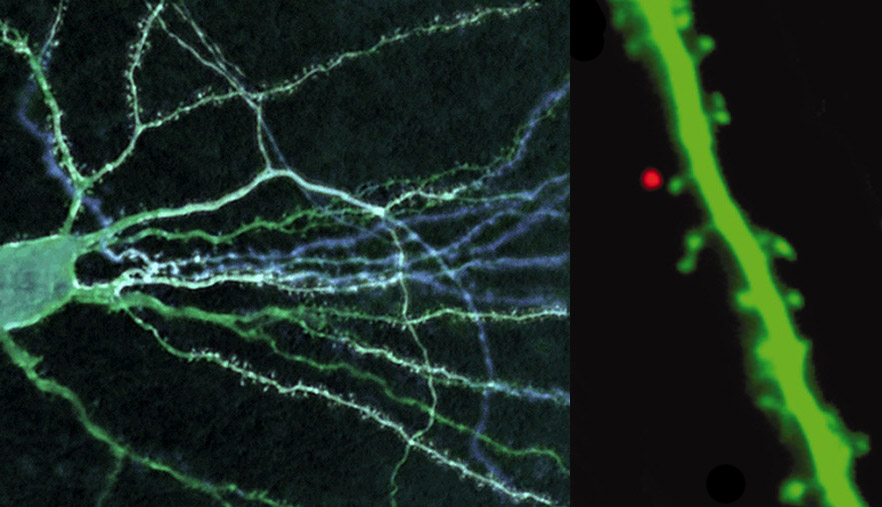
Egy idegsejt fluoreszcens képe, valamint az idegsejt egy apró részének, a mintegy 0,5 μm méretű dendritikus tüskének aktiválása lézerfény felvillanással bebörtönzött glutaminsav segítségével.
Az itt bemutatott példán túl számos olyan terület van, ahol a bebörtönzött molekulákat felhasználják. Nem csak nukleotidokat (ATP) és kismolekulás neurotranszmittereket (glutaminsav), de ionokat (Ca2+), jelátviteli utakat szabályozó vegyületeket (IP3), génexpressziót moduláló hormonokat (β-ecdysone), sőt RNS és DNS fragmenseket és teljes fehérjéket (például G-aktin, protein kináz A) is előállították már bebörtönzött formában. Ahogy máskor is bebizonyosodott, a kémia itt is olyan hasznos eszközöket képes létrehozni a biológiai kutatás számára, amivel korábban elérhetetlen részletességgel válnak vizsgálhatóvá a legkülönbözőbb élettani folyamatok.





Utolsó kommentek