 A vizsgált rendszer feletti minél teljesebb kontroll a kutatók kívánságlistájának örök dobogós helyezettje. Ennek érdekében számtalan, a maga korában sci-fi-be illő eszköz született a tudomány történetében. Elég csak például a genetikai módosításokra gondolni, amikkel az adott kísérleti rendszer egy-egy specifikus tulajdonsága vált nagyon jól kézben tarthatóvá. Az agykutatásban - és különösen a neuronális hálózatok működésének tanulmányozásában - az egyik ilyen kontrollálandó paraméter az idegsejtek ingerelhetősége. Ennek befolyásolására számtalan eszközt fejlesztettek ki, de az ember persze mindig szebbet, jobbat akar. Miért ne lehetne például távolról ki-bekapcsolgatni adott neuronokat? Nos, lehet. Sőt, egyre növekszik a rendelkezésre álló módszerek száma. Nemrégen már bemutattunk egy technikát, ami lehetővé tette, hogy kék, illetve sárga fénnyel aktiváljuk vagy gátoljuk az idegsejteket. Az élet azonban azóta sem állt meg, máris két újabb módszer került be az eszköztárba.
A vizsgált rendszer feletti minél teljesebb kontroll a kutatók kívánságlistájának örök dobogós helyezettje. Ennek érdekében számtalan, a maga korában sci-fi-be illő eszköz született a tudomány történetében. Elég csak például a genetikai módosításokra gondolni, amikkel az adott kísérleti rendszer egy-egy specifikus tulajdonsága vált nagyon jól kézben tarthatóvá. Az agykutatásban - és különösen a neuronális hálózatok működésének tanulmányozásában - az egyik ilyen kontrollálandó paraméter az idegsejtek ingerelhetősége. Ennek befolyásolására számtalan eszközt fejlesztettek ki, de az ember persze mindig szebbet, jobbat akar. Miért ne lehetne például távolról ki-bekapcsolgatni adott neuronokat? Nos, lehet. Sőt, egyre növekszik a rendelkezésre álló módszerek száma. Nemrégen már bemutattunk egy technikát, ami lehetővé tette, hogy kék, illetve sárga fénnyel aktiváljuk vagy gátoljuk az idegsejteket. Az élet azonban azóta sem állt meg, máris két újabb módszer került be az eszköztárba.A már korábban bemutatott módszer lényege az volt, hogy két rodopszin fehérjét, a channelrhodopsin-2-t és a halorhodopsint juttatták be mesterségesen a kísérleti állatok genetikai állományába. A channelrhodopsin-2 egy Na+ iont áteresztő ioncsatorna, ami kék fény hatására nyílik ki. A beáramló Na+ ionok pedig tüzelésre serkentik az idegsejtet. A halorhodopsin szintén egy ioncsatorna, ami azonban sárga fénnyel aktiválható és nem Na+, hanem Cl- ionokat enged át, amik pedig lecsendesítik a sejtet. Kék és sárga fénnyel megvilágítva az ezen csatornákat kifejező sejteket tehát valóban ki-be lehet kapcsolgatni őket. A rendkívül ötletes megoldás ellenére, mint minden módszernek, természetesen ennek is megvannak a maga hátrányai. Az egyik, hogy szükség van hozzá egy genetikai beavatkozásra, hiszen így juttatják be az említett rodopszin fehérjéket. A másik hátrány, hogy fénnyel aktiválja a csatornákat. A fény ugyan egy rendkívül sok jó tulajdonsággal bíró eszköz (mind térbelileg, mind időben nagyon pontosan lehet adagolni, nem roncsolja a szöveteket, stb.), és emiatt igen széleskörűen alkalmazzák, azonban nem képes elérni a mélyebben fekvő agyterületeket. A most bemutatandó két módszer ezeket a hátrányokat küszöböli ki.
Nézzük előbb az utóbbit. Ha a fény valamiért nem tetszik nekünk, milyen más módon tudnánk aktiválni bizonyos ioncsatornákat? Természetesen specifikus molekulákkal. Az ioncsatornák egy jelentős része ugyanis a hozzájuk specifikusan kötődő vegyületek (ligandok) hatására nyílik meg. Egy kismolekulát pedig akármilyen mélyre be lehet juttatni az agyba. Akár úgy, hogy megvárjuk, amíg bediffundál, akár úgy, hogy egyből a kívánt helyre injektáljuk. Most már csak egy jó ioncsatorna-ligand kombót kell találnunk ehhez. Nem használhatunk persze széleskörűen előforduló ioncsatornát, mert akkor a ligand bejuttatása sok más folyamatot is beindítana, nem csak azt, amire mi kíváncsiak vagyunk. A Nature Methods szaklapban publikált módszer szerint a patkány vanilloid receptor azonban felhasználható erre a célra. Ezt ültették be egérbe, pontosabban az egér agyának meghatározott típusú idegsejtjeibe. Ezután a receptor egy ligandját, a kapszaicint (ez egyébként a csípős paprika erejét adó vegyület) adagolták, és nem csak izolált agyszeletben, de mint a mellékelt videó is mutatja, élő állatban is képesek voltak a megcélzott neuron populációt (esetünkben a köröző mozgást kiváltó idegsejteket) aktiválni.
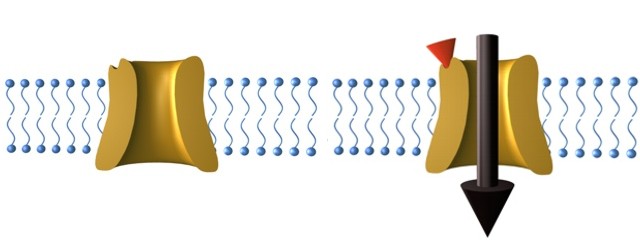
A kapszaicin kötődésének hatására kinyílik a Na+ ioncsatornát formáló receptor
Ennek a módszernek is megmaradt azonban az a hátránya, hogy az egész egy genetikai módosítással indul. A genetikai beavatkozások ugyan ma már szinte rutinszerűen hajthatóak végre, azonban több probléma is adódik velük. Más módszerekkel összevetve meglehetősen időigényesek, drágák, és nem utolsósorban komoly szakértelmet igényelnek, amik többnyire csak speciálisan erre szakosodott laboratóriumokban elérhetőek. Sokkal egyszerűbb lenne, ha a távirányítható sejteket egy normál, vad típusú állatban helyben ki lehetne alakítani. Erre kínál megoldást egy szintén a Nature Methods-ban leírt módszer. Ebben ha lehet még trükkösebben érik el a neuronok ingerelhetőségének módosítását, ugyanis nem egy új csatornát visznek be, hanem egy meglévőt módosítanak úgy, hogy ki-bekapcsolható legyen. Mindezt úgy érik el, hogy egy specifikus molekulát adnak a rendszerhez, ami kovalens kötéssel a csatornához kötődik. Nyújtott állapotában a molekula feje épp úgy helyezkedik el, hogy bedugaszolja a csatornát. Amikor azonban 380 nm-es, az ultraibolya tartomány határán lévő fénysugárral megvilágítják, akkor a molekula átrendeződik, "összehúzódik", és ezáltal kihúzza a dugót a csatornából.
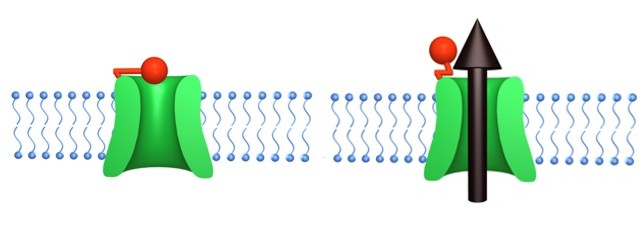
380 nm-es fénysugárzás hatására megszűnik a K+ ioncsatorna gátlása
Mivel a csatorna bedugaszolt állapotában a K+ ionok nem tudnak kijutni a membránon, ezáltal a sejt nem képes többé tüzelésre. A besugárzás hatására azonban visszanyeri normál funkcióját.
Ezek az eredmények természetesen messze vannak attól, amit a távirányítás szó sugall, nevezetesen az agyfunkciók - és különösen a magasabb rendű agytevékenységek - direkt befolyásolásától. Nem utolsósorban éppen azért, mert ma még meglehetősen korlátozottak abbéli ismereteink, hogyan jön létre egy komplex viselkedési forma egy adott agyterület aktiválását követően. Azonban éppen ez a terület, a neuronális hálózatok vizsgálata profitálhat majd ezen módszerekből azáltal, hogy egy-egy terület vagy adott sejttípusok ingerlését követően vizsgálja az erre kapott válaszokat.
Persze ki tudja, még az is lehet, hogy egyszer egy valódi kétirányú agyi interfésznek is alapjául szolgálnak majd ezek a technikák.






Utolsó kommentek